临床产品
杏彩体育官网app12款创新药进入III期5款来自中国药企
产品特点: 根据全球临床试验收录网站clinicaltrials和中国临床试验登记平台chinadrugtrials,3月共12款创新药进入III期阶段,其中5款来自中国药企。这些在研药物覆盖靶点不乏HER2产品说明
根据全球临床试验收录网站clinicaltrials和中国临床试验登记平台chinadrugtrials,3月共12款创新药进入III期阶段,其中5款来自中国药企。这些在研药物覆盖靶点不乏HER2、CLDN18.2、IL-5等热门靶点,也包括apo(a)和C1s这类新颖靶点。本文筛选其中6款重点产品加以介绍。
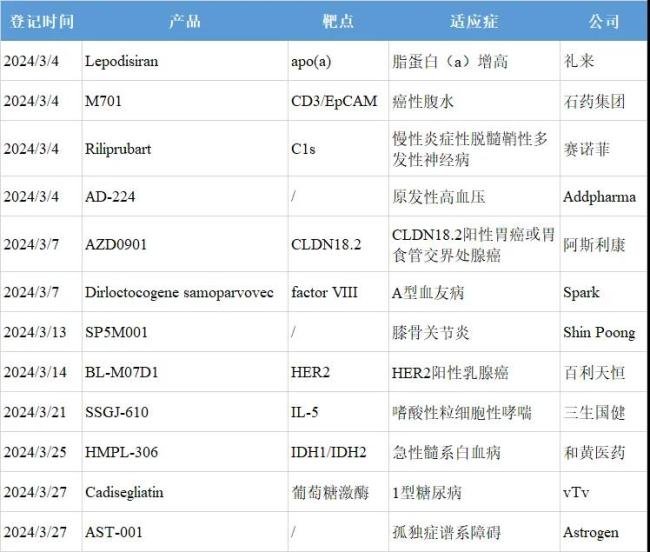
注:1.信息来源于clinicaltrials和chinadrugtrials。2.仅登记创新药,微创新和生物类似药不包括在内。3.同一款药物在同一天启动多项III期临床,适应症合并记录;同一款药物在一个月内启动多项III期临床,以最早登记者准。4.EpCAM:上皮细胞黏附分子;IDH:异柠檬酸脱氢酶。
脂蛋白(a)主要由低密度脂蛋白(LDL)样微粒与载脂蛋白(a)(即apo(a))组成,被认为是心肌梗死、中风和外周动脉疾病等心血管疾病(CVD)的危险因素。虽然尚未有研究确定脂蛋白(a)的危险临界值,但约20%的脂蛋白(a)水平超过125nmol/L(或约50mg/dL)。
2018年10月,礼来与Dicerna达成合作,以5.5亿美元的总交易额引进包括Lepodisiran在内的7款在研药物。
去年11月,礼来在美国心脏协会科学年会(AHA 2023)上公布了Lepodisiran的首个I期研究数据。结果显示,在第337天时,单剂量(608mg)Lepodisiran可将患者的脂蛋白(a)水平降低94%,并持续近一年。基于I期研究的积极结果,礼来已在今年3月启动了该药物的III期临床试验,拟招募12500例脂蛋白(a)水平的有冠状动脉疾病或有首次心血管事件风险的患者。
除了礼来以外,安进和诺华布局的针对脂蛋白(a)的小核酸药物也进入了III期阶段。安进开发的Olpasiran同为RNAi疗法,其在II期研究中可将患者的脂蛋白(a)水平降低97.5%,疗效显著。诺华开发的Pelacarsen则是一款反义疗法,其在I期研究中可将患者的脂蛋白(a)水平降低85.3%。
M701是石药集团子公司友芝友生物开发的一款CD3/EpCAM双抗,也是目前唯一一款进入临床阶段的国产CD3/EpCAM双抗。
I期研究结果显示,在16例可评估疗效的患者中,癌性腹水情况得到缓解的患者比例为62.5%(10/16),疾病控制率(DCR)为100%,中位总生存期(OS)为152天。
癌性腹水是一种常见于晚期肺癌和乳腺癌等癌症患者的并发症,其成因是肿瘤细胞侵袭组织和引起负性因子释放等导致内皮细胞异常和渗出液增多、以及肿瘤细胞堵塞淋巴管导致淋巴液积聚。癌性腹水会导致患者产生胸闷、呼吸困难、胸痛、恶心、呕吐等严重影响生活质量的症状,同时也会影响医生对当前全身治疗药物疗效的评估。
国内临床上仍然缺乏针对癌性腹水的药物,欧美国家推荐胸腔内给予滑石粉以使得胸膜黏连,从而抑制渗出液产生,但有较强的副作用。此前,曾有一款药物——卡妥索单抗获批欧洲药品管理局(EMA)批准用于治疗癌性腹水,但该药物实则无法解决实际需求,已退市。
Riliprubart是一款补体C1s单抗。今年3月,赛诺菲在美国神经病学会年会(AAN)上公布了Riliprubart治疗慢性炎症性脱髓鞘性多发性神经病(CIDP)的II期研究数据。结果显示,88%从标准治疗(免疫球蛋白/)转换到Riliprubart的患者的病情有所改善或保持稳定。
此前,赛诺菲已推出了一款C1s单抗——Sutimlimab(商品名:Enjaymo),不过其适应症为用于冷凝集素病患者降低由于溶血导致的红细胞输注需求。
AZD0901(CMG901)为康诺亚与乐普生物共同开发的CLDN18.2 ADC,由CLDN18.2特异性抗体、可裂解连接子及毒性载荷甲基澳瑞他汀E(MMAE)组成。该产品是首个在中国及美国均取得临床试验申请批准的CLDN18.2 ADC。
2月23日,康诺亚宣布,其非全资附属公司KYM Biosciences(康诺亚拥有70%权益)与阿斯利康签署全球独家许可协议,将AZD0901研究、开发、注册、生产及商业化的全球权益授权给后者。KYM将收取6300万美元预付款、最多11.25亿美元的额外潜在付款,以及分级特许权使用费。
康诺亚于2023年ASCO大会上公布的I期研究结果显示,在89例可评估疗效的CLDN18.2阳性胃癌或胃食管交界处腺癌患者中,确认的客观缓解率(cORR)为32.6%。
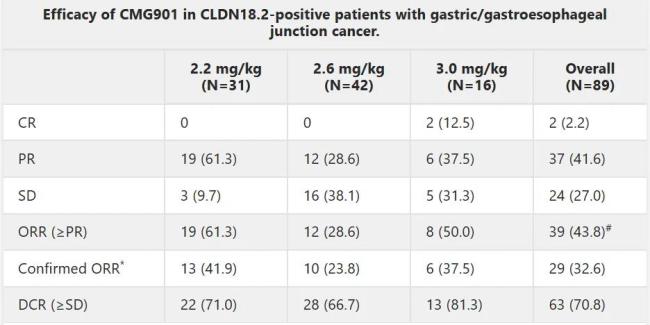
作为热门靶点CLDN18.2赛道的竞争已日渐激烈。根据医药魔方数据库,仅国内企业就有约59款临床在研CLDN18.2靶向药物,药物类型涵盖单抗、双抗、三抗、CAR-T疗法和ADC等。在12款已进入临床开发阶段的国产CLDN18.2 ADC中,IBI343(信达生物)与AZD0901处于第一梯队。
SSGJ-610是一款IL-5拮抗剂,通过阻断IL-5与嗜酸性粒细胞表面受体的结合,从而降低血液、组织、痰液中的嗜酸性粒细胞水平,降低嗜酸性粒细胞所介导的炎症,达到治疗嗜酸性粒细胞性重度哮喘的作用。
今年1月,SSGJ-610(100/300mg,每周1次)治疗嗜酸性粒细胞水平升高的重度哮喘的II期研究达到主要终点。结果显示,治疗第16周,两个剂量组与安慰剂组1秒用力呼气量(FEV1评分)较基线ml,经协方差分析,两个剂量组相较安慰剂的组间差值分别为121ml和190ml,其中300mg剂量组显著优于安慰剂组(p0.05),且与同靶点数据比较,显示出好于美泊利珠单抗(第32周较基线ml)和Reslizumab(各剂量组第16周改善分别为187ml和248ml、相较安慰剂组的组间差值分别为93ml和137ml)的趋势。
截至目前,全球已有两款IL-5单抗获批上市,即Reslizumab(Teva/默沙东/UCB)和美泊利珠单抗(GSK)。据GSK财报,2023年美泊利珠单抗销售额约为21亿美元。
SSGJ-610是首款进入III期阶段的国产IL-5单抗。除了三生国健以外,恒瑞医药和融捷康生物的产品也已进入临床阶段。此外,正大天晴和百奥泰布局了美泊利珠单抗生物类似药,其产品均处于I期阶段。
哮喘是由多种细胞以及细胞组分参与的慢性气道炎症性疾病,临床表现为反复发作的喘息、气急,伴或不伴胸闷或咳嗽等症状。我国的哮喘患病率为4.2%,推算我国有4570万哮喘患者。重症哮喘占哮喘人数的5.99%,是哮喘致残、致死的主要原因。嗜酸性粒细胞哮喘是最常见的临床表型,持续的气道嗜酸性粒细胞炎症极易促使哮喘进展为重度。
重度哮喘的长期治疗药物包括中高剂量的吸入性糖皮质激素和长效β2受体激动剂,以及其他控制用药,但仍有5%~10%患者停药或药物减量后症状反复,且长期大量使用糖皮质激素会导致全身不良反应的发生。
IDH1/2的突变是各种类型的血液肿瘤和实体瘤中常见的基因变异,如急性髓系白血病(AML)、胆管癌、软骨肉瘤和神经胶质瘤。突变型的IDH造成2-羟基戊二酸积累,导致细胞分化受阻,从而诱导肿瘤的恶性发展。
一些罕见个案中,患者同时携带IDH1和IDH2突变。在AML及胆管癌中,IDH突变亚型转化是对IDH产生获得性耐药的主要机制之一,无论是由IDH1突变转为IDH2突变,或反之亦然。因此,同时抑制IDH1和IDH2突变可能是克服耐药性和提高临床疗效的具有潜力的策略。
2022年进行系列改革调整的和铂医药,在去年的全球生科寒冬里已经凭借自主造血迎来了业绩“高光”。
截至目前,服用该公司含有红曲成分保健品,死亡的消费者人数已达到4人。从今年1月开始,小林制药就陆续收到报告。有消费者在食用了,小林制药含红曲的产品后出现健康问题。
回溯其发展历史,不难发现康恩贝2019年至2022年之间的业绩起伏极大。不过,调整发展战略之后,将重心聚焦于中药大健康领域,康恩贝似乎看到了走出低谷的曙光。
北京商报记者更换多个关键词和“红麹胆固醇颗粒”产品的包装图片进行搜索,目前各大电商已搜索不到涉事产品。
截至3月27日,国内四大药商中,国药控股、华润医药已发布2023年财报,两者营收及归母净利润均实现增长。
2023年对于国内上市创新药企来说,是面临巨大挑战和困境的一年,这些挑战来自外部环境也来自内部变革。
生物农药领航绿色农业时代,在创新技术推动和市场潜力展现的同时,面临生产成本、市场接受度等挑战,需政策、技术和市场综合发力以实现广泛应用。
上一篇:ivd临床试验的应用及发展趋势 下一篇:国家药监局关于医疗器械临床试验监督抽查情况的通告(
